活性氧检测试剂盒(Reactive Oxygen Species Assay Kit)是一种利用探针DCFH-DA进行活性氧检测的试剂盒。DCFH-DA本身没有荧光, 可以自由穿过细胞膜, 进入细胞内后, 可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成强绿色荧光物DCF激发波长488nm,发射波长525nm附近有最大波峰,强度与细胞内活性氧水平成正比。
本试剂盒本底低,灵敏度高,线性范围宽,使用方便;可以测定100-500个样品。DCF的荧光光谱与FITC特别相似,流式检测时,可以用FITC的参数设置检测DCF。
包装信息
1. 装载探针
对于药物处理时间较短(<2h)的细胞或预计ROS效应较弱,可先或同时装载DCFH-DA探针。反之,对于细胞药物处理时间较长(>6h)的细胞或预计产生ROS效应较强 , 可后装载探针DCFH-DA。
①在暗室中加入 DCFH-DA 于无血清培养液,推荐初始工作浓度为2µM。对不同的细胞或处理,DCFH-DA 工作浓度可为 2µM-10µM,需要进行预实验确定合适的浓度,总体稀释倍数应在1:100-1:500以上,避免DMSO对细胞的影响。
②37℃孵育细胞20min-30min。
2. 细胞收集
悬浮细胞:细胞收集后重悬于稀释好的DCFH-DA中,细胞密度为105-106 个/ml,37℃细胞培养箱内孵育20min。每隔3-5min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。300g离心5min(1500 rpm/min),用PBS洗涤1-2次。
贴壁细胞:去除细胞培养液,加入适当体积稀释好的DCFH-DA。加入的体积以能充分盖住细胞为宜,通常对于六孔板的一个孔加入稀释好的DCFH-DA不少于1ml。37℃细胞培养箱内孵育20min。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。用胰酶消化细胞(0.25%胰酶),加入完全培养基终止消化,制成细胞悬液。300g离心5min(1500rpm/min),用PBS洗涤1-2次。
3. 组织样本
①选取的组织立即放入预冷的组织培养液或PBS中,清洗血迹及污染物。去除组织块中的坏死成分、纤维、脂肪及血管。
②用眼科剪将组织块剪成1 mm³左右小块,放在预冷的组织培养液或PBS中并进行漂洗,洗去剪碎的细胞碎片。
③将300目尼龙网扎在烧杯上,将剪碎的组织放在网上,以眼科镊或刮刀轻搓组织块,边搓边以PBS冲洗,直至将组织搓完。
④收集细胞悬液,500 g离心10 min去上清,并用PBS洗1-2次,并重悬制备单细胞悬液,细胞计数总数不少于106个细胞。
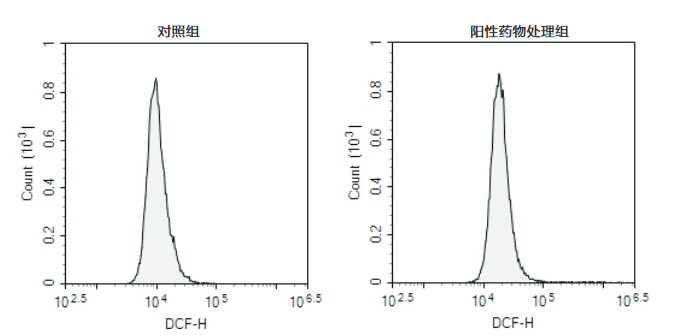
说明:仅在阳性对照孔中加入TBHP作为阳性对照,其余孔不必加入TBHP。通常活性氧阳性对照在刺激细胞20-30min后可以显著提高活性氧水平。
4. 检测
①对于原位装载探针的细胞样本可以用荧光显微镜直接观察拍照。
②收集细胞后可以用荧光酶标仪检测。
③收集细胞后也可以用流式细胞仪检测。
备注:
(1)阳性对照可以按照1:200-1:500的比例使用。例如装载好探针的细胞共1ml,可以加入2μl-5μl的阳性对照刺激。通常刺激后20-30分钟内可以观察到非常显著的活性氧水平升高。对于不同的细胞,活性氧阳性对照的效果可能有较大的差别。如果在刺激后30min内观察不到活性氧的升高,可以适当提高活性氧阳性对照的浓度。如果活性氧升高得过快,可以适当降低活性氧阳性对照的浓度。
(2)对于某些细胞,如果发现没有刺激的阴性对照细胞荧光也比较强,可以按照更大比例稀释DCFH-DA。探针装载的时间也可以根据情况在15-60min内适当进行调整。
(3)活性氧阳性对照仅用于作为阳性对照的样品,并不是在每个样品中都需加入活性氧阳性对照。
产品图片: